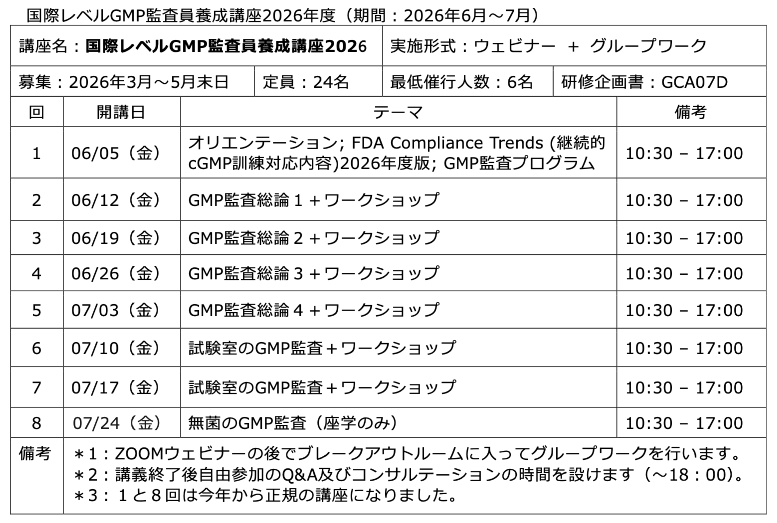
FDAのWarning letter(320-16-31) データインテグリティ

医薬品GMPに関するFDAのWarning letterを紹介します。今回は、中国のAPI製造施設です。
■ホームページアップデート日:2016年9月21日
—————————————
WL#:320-16 ...
GMPを勉強しよう-56-PIC/S GMPデータインテグリティドラフト-201608

矢継ぎ早とはこのことですね。
FDAのドラフトガイダンスが4月に、MHRAのドラフトガイダンスが7月に、そしてとうとうPIC/Sのドラフトガイダンスが8月10日に発行されました。
昨年5月のWHOガイダンスを含 ...
GMPを勉強しよう-55−MHRAのドラフトDI-6(総括)

最後に、現行のガイダンスとドラフトガイダンスを比較してみます。
MHRAのガイダンス(2015年3月)のガイダンスに記載されている用語は、以下のとおりです。
項目の末尾に○をつけたものは、用語の定義があるもので ...
GMPを勉強しよう-54-MHRAのドラフトDI-5(アルコア)

用語の定義や、その周辺の注意点などを少し書いておきます。
<データについて>
データインテグリティを勉強していると何回も出てくるのが「アルコア」です。「データは、アルコアであるべき」と”should ...
GMPを勉強しよう-53-MHRAのドラフトDI-4(定義)

このドラフトガイダンスのテーマである定義なのですが、以下イタリック体のところは、用語の定義であるとして、紹介しています。
しかし、用語の定義と思われる文章でもイタリック体になっていないところ(7.Data Transfer ...
FDA Warning letter(再表示医薬品;サプライチェーン)

FDAのWarning letterが掲載されました。
医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、中国のAPI製造(再表示)施設です。CoAの改ざんが、サプライチェーンの問題に ...
GMPを勉強しよう−52−MHRAのドラフトDI-3 (システム設計)

次は、データの品質とインテグリティを保証するための「システム設計」について書かれています。
システム設計の例をあげています。原則は、データの重大性に応じて適切な管理をしつつ、「アクセス」、「使用」、「配置」のしやすさに配慮 ...
GMPを勉強しよう−51−MHRAのドラフトDI-2(データの重大性とリスク)

次は、データインテグリティの重大性とリスクに関して書かれています。
当然のことですが、データの管理は、品質特性の影響の重大性に見合ったものにすべきであると書かれています。
データは、2種類あります。マニュアル ...
GMPを勉強しよう−50−MHRAのドラフトDI-1(データインテグリティ)

MHRAのドラフトガイダンスは、背景情報から始まっている。
<背景>
システムは、紙へのマニュアル入力から、コンピュータ化システムの電子化へと技術的な変遷を遂げている。しかし、規則が求める主たる目的は変わらない ...
GMPを勉強しよう−49-データインテグリティまだドラフトです
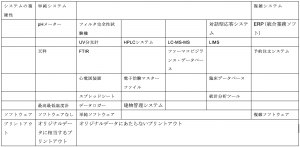
MHRAのデータインテグリティのドラフトガイダンスですが、まだドラフトです。あたりまえか(^_^)。
ドラフトですから、ななめ読み程度で「なるほどね」という姿勢が良いのではないでしょうか。とは言うものの、データインテグリテ ...