FDA Warning letter(CMS Case: 506761)注射剤の目視検査

FDAのWarning letterが掲載されました。
医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、アメリカの製剤製造施設です。
ファイザーの医薬品製造施設である&# ...
EMAのNon-compliance Report(無菌API)イタリア当局

このNon-Compliance Reportは、イタリア当局から発行されました(発行日2017年1月5日Report No : IT/GMP/E/1-2017)。対象の会社は、ブラジルの無菌API/医薬品製造業者です。
...
GMPを勉強しよう‐57‐データインテグリティ管理手順
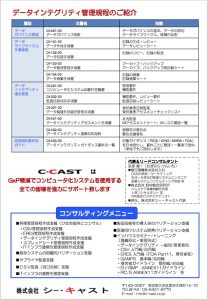
先週、ある委員会に出席していたら、こんなコピーを受け取った。内容は、「データインテグリティ管理規程の紹介」というもので、こちらのページは裏面。有名な荻原さんがまとめた資料で、データインテグリティを管理していくための一式が揃っている。
FDAのWarning letter(無菌製剤の粒子汚染)WL320-17-19

医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、イギリスの無菌製剤の製造施設です。筆頭に上げられている欠陥は、「粒子の汚染」でした。この査察は2016年に実施されましたが、2015年の査察でも同 ...
FDAのWarning letter(無菌製品の製造手順211.113(b))WL# FLA-17-06

今回は、先週FDAのホームページに掲載されたWarning letterの中から、セクション211.113に関連する指摘事項と、FDAの期待する所を見ていきたいと思います。
例にあげた今回の対象会社は、アメリカの製剤製造施 ...
FDAのWarning letter(API再包装)WL#320−17−14

医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、中国のAPI製造施設です。再包装作業に関する指摘事項です。
■ホームページアップデート日:20170118
WL#: 320- ...
FDAのWarning letter(3通)20170118

FDAのWarning letterが3通発行されています。
1通は、データインテグリティに関する指摘でした。
1通は、中国のAPI製造業者で、オリジナルのAPIメーカーの名前と住所を自社発行のCoAを自社入れ ...
FDAのFINAL GUIDANCE CGMP for combination products(201701)

FDAのファイナルガイダンスが発行されました。CGMP requirements for combination productsです。ドラフトが出されたのが2015年1月ですから、ピッタリ2年で最終版になりました。
ダウ ...
FDAのFinal Guidance:Nonproprietary Naming of Biological Products

FDAが以下のガイダンスの最終版を発行しました。
ブログを開いて、以下のガイダンス名をクリックすると、ダウンロードできます。
Nonproprietary Naming of Biological Produc ...
PIC/S GMPの改訂部分をマークしてみた

こんな感じです。結構時間のかかる作業だったが、これをしておくと解釈や改訂/変更の趣旨がわかり、スライドや資料を作るのに便利かなと思った。
多分、ECAのメンバー欄には、EUの改訂のときのチェックが入っていると思うけど、それ ...