FDA Warning letter(320-18-61):API(中国):OOS調査;品質部門(データインテグリティ)

今週は、FDAのWarning letterが1通掲載されました。今回の対象会社は、中国のAPI製造施設です。データインテグリティの問題が指摘されています。製造領域でのデータインテグリティの指摘もありますので、社内でディスカッションす ...
EMAがリコール。バルサルタン原薬から発がん性物質を検出、FDA-483は…

EMAが発ガン性物質を含むAPIのリコールを行いました。これは、中国で製造された高血圧症治療薬API(一般名Valsartan)です。このAPIから発がん性の不純物(N-nitrosodimethylamine)が検出されたとのことで ...
FDA Warning letter(320-18-59):OTC受託製造(中国):出荷判定試験;原料の受入試験;安定性プログラム;バッチ製造記録の記入

今回の対象会社は、中国のOTC受託製造施設です。
指摘は、1)出荷判定試験; 2)原料の試験; 3)安定性プログラム; 4)バッチ製造記録の記入に関する4項目です。
WL#: 320- ...
FDA Warning letter(320-18-59):API(中国):残留試験;クリーニングバリデーション;安定性試験;データインテグリティ

今週は、FDAの警告書が2通出ていました。1通は中国のAPI製造施設で、もう1通は中国のOTC受託製造施設です。さらに、調剤薬局の警告書も1通出ています。
今回紹介する対象会社は、中国のAPI製造施設です。
( ...
FDA Warning Letter(320-18-58):API(中国):品質部門;データインテグリティ

今週は警告書が1通出ています。中国のAPI製造施設です。品質部門の責任とデータインテグリティの問題が指摘されています。
データインテグリティの問題は、プレビューしてデータが上書きできる設定になっていました。そのため、前の試 ...
今日は1日中、PIC/S GMP 14版の変更作業をしていた。

7月1日施行の「PIC/S GMP 14版 PartⅠ」の変更作業をしていたら、1日終ってしまった。現行のEU GMPと比べてみると、ほぼ同じ内容になった感がある。
この際一気にEUGMP一本で対応していくと作業がダブらず ...
FDA Warning letter(320-18-57):OTC(フランス):出荷判定試験;コンポーネントの確認試験;品質管理部門(QCU);安定性プログラム;プロセスバリデーション

医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、フランスのOTC医薬品製造施設です。
指摘は、1)出荷判定試験; 2)コンポーネントの確認試験; 3)品質管理部門(QCU); 4)安 ...
FDA Warning Letter(320-18-56):無菌OTC(台湾):微生物試験のデータインテグリティ;安定性プログラム;年次製品照査

医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、台湾の無菌OTC製造施設です。
指摘は、1)微生物試験のデータインテグリティ; 2)安定性プログラム; 3)年次製品照査に関する項目で ...
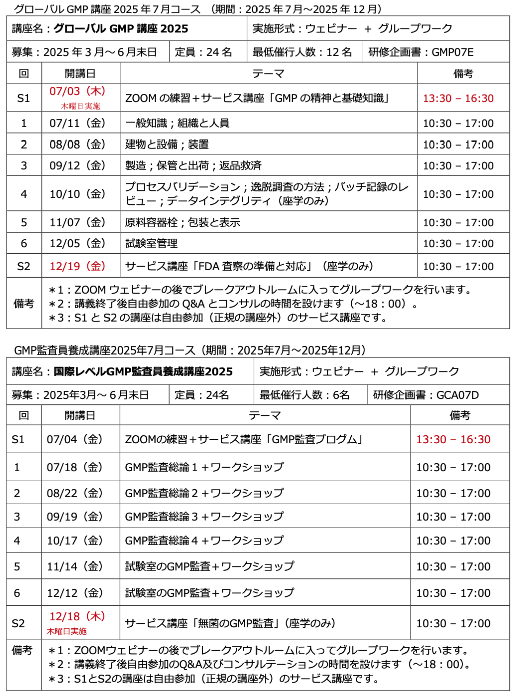
公開セミナーを開催しようと思う(2):今年の計画

いい場所が見つかりました!そこで、以下のセミナーおよび養成講座を計画しました。夏以降に実施する予定です。具体的な日程が決まりましたら、メルマガおよびホームページでお知らせします。まずは、備忘録を兼ねて書き込みました。
◆デ ...
FDA Warning letter(320-18-55):API/製剤(オーストラリア):OOS;品質部門;試験室管理;データインテグリティ

医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、オーストラリアのAPIおよび製剤製造施設です
指摘は、APIが1)OOS調査とCAPA; 2)品質部門に関する2項目、製剤が1)試験室 ...