今年もよろしくお願い申し上げます

昨年はコロナで始まりコロナで終わりました。そして、今年もコロナの緊急事態宣言で始まり、先行きどうなるのだろうと思っている次第です。
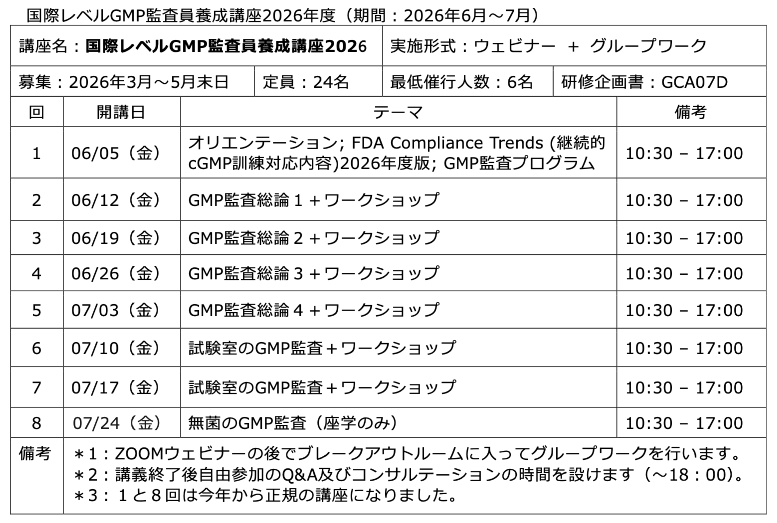
当所の人材育成講座も昨年はウェビナーに全面切り替えして行いましたが、今年も継続することにな ...
GMPは心です

もう随分昔の話です。メリーランドの小川の辺りにあるビストロで、ある人とGMPの話をしていました。私の尊敬する大先輩です。
GMPをスレスレで通したい、そんな会社が多いという話をしていました。その頃「これはGMPの要件ですか ...
オンラインセミナー「FDA査察の準備と対応」の募集案内

グローバルGMP講座の補講として「FDA査察の準備と対応」のセミナー開催に際し、本講座受講生以外の方の募集も行いますので、お知らせいたします。
この公開セミナーは、グローバルGMP講座の補講としてのみ実施しております。他に ...
FDA Warning letter 320-20-08

今週のWarning letterなんですが、
海外査察(CDER発信)では、先週出された2通のWarning letter(320-21-07と320-21-09)の間の番号320-21-08が掲示されました(ニコッ)。 ...
FDA Warning letter(320-20-47):

世界的なコロナ禍においても、CDER管轄(米国外)Warning letterだけでも50近く発行されています。2000年前((・.・;):西暦2000前すなわち1990年代です。)の厳しさに戻ってきた感があります。
ちな ...
FDA査察が再開したら、こんなことに注意しましょう!FDAガイダンスの紹介

FDA査察が再開されたら、このガイダンスに記述されたことはレビューされる可能性が高いと個人的に感じました。そのため、皆さんに注目していただきたく、紹介します。
新しく発行された以下のガイダンスは、即施行されます。
FDA Trends 最新版

パートナーのジョン・リー氏から最新版の”FDATrends”のプロモーションビデオが届きました。ホームページに貼っておきましたので、ご覧ください。
18分のビデオなので、見ごたえありますね。この完全 ...
FDAのバイオサンプル保管に関するガイダンス

FDAは、2020年8月18日にバイオサンプルの保管要件を改訂する最終ガイダンスを発行しました。今まで必要な保管量は完全な試験の5倍でしたが、今回の最終ガイダンスで単回投与の医薬品では30ユニット、複数回投与の医薬品では3ユニットに削 ...
新型コロナ禍でのFDA査察に関するガイダンス

FDA査察に関するガイダンスが8月19日に発表されました。
要点は、以下のとおりです。
ウイルスパンデミック時の国内外の査察に関する最終ガイダンスです。 FDAは、7月20日に「ミッションクリティカル」な医薬品 ...
FDA Warning letter (320-20-40):API(カナダ):経営陣の監督

(“..)φ:また出ましたね、”management oversight”。しかし今回は文章中ではなく、1項目とって(と言ってもAPIなので、適用セクションの項目はないのですが)太字で書かれています ...