Warning letter(320-19-27):API(インド):逸脱調査;装置のメンテナンス

FDAのWarning letterが掲載されました。今回の対象会社は、インドのAPI製造施設です。その他に米国のOTCメーカーとインドの製剤メーカーにWarning letterが発行されました。
OTCメーカーのWar ...
FDA Warning letter(320-19-25):中国(OTC):出荷判定試験;原料の受入試験;プロセスバリデーション;品質部門

医薬品GMPに関するFDAのCDERが発行したWarning letterを紹介します。対象会社は、中国のOTC医薬品製造施設です。
指摘は、1)出荷判定試験; 2)原料の受入試験; 3)プロセスバリデーション; 4)品質 ...
できた!GMP監査事例ノート

事例ノートは、監査員養成講座の講義中に具体的事例を紹介したり、ワークショップの与件として使うための個人的な「あんちょこ」です。監査用なので、中身はFDA-483 やWarning letterの事例ではなく、「実際に見た、聞いた、経験 ...
FDA Warning letter:受託試験施設(アメリカ):試験法;試験記録(GDocP);監査証跡とアクセス管理(DI);保守校正

医薬品GMPに関するFDAのWarning letterを紹介します。
あまり警告書では見られない微生物試験の問題が出ていましたので、紹介します。かなり前に、APIの微生物試験で好ましくない菌がマスキングされて合格判定され ...
FDA Warning letter(320-19-24):インドのOTC:品質部門;クリーニング;データインテグリティ

今週はFDAのWarning letterが多く掲載されました。そのうちのCDER発行のものを1通紹介します。
医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、インドのOTC製造施設 ...
FDA Warning Letter (320-19-21):インドの製剤製造施設:データインテグリティ他

今週の2通あるのですが、そのうちの1通を紹介します。
今回の対象会社は、インドの製剤製造施設です。
指摘は、1)データインテグリティ; 2)コンピュータセキュリティ; 3)に関する項目です。
WL# ...
今週のFDA Warning letter

今週は、このサイトでカバーしているWarning letterが、ざっと6通掲載されました。ざっとというのは変ですね。どうしようか迷ったものがありましたので、正確な数字ではないと言うことです。
ちなみに、このサイトではいわ ...
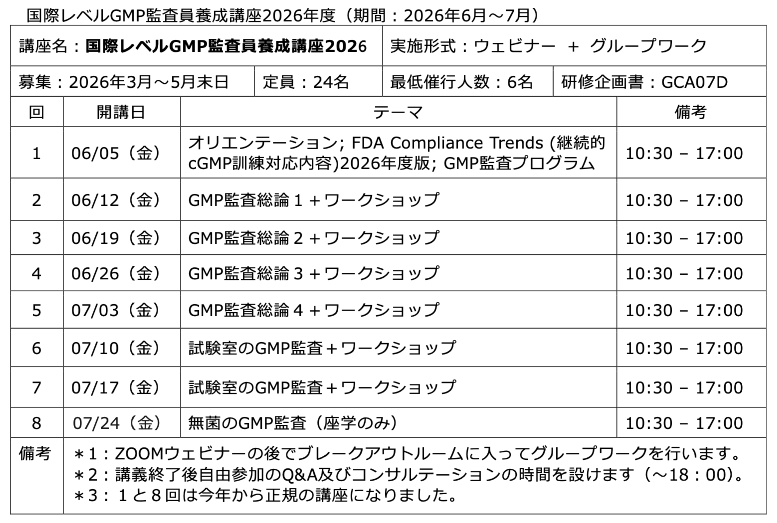
講座ノートがやっと完成!

今回の講座開設にともない、3月から本格的に講座ノート(テキストではなく副読本です)の見直しをしてきました。今回は平成最後の大改訂(笑)で、旧版のコースノートやチェックリストを徹底的に見直し、新たに講座ノートとして(旧版を改訂版で引き継 ...
FDA Warning letter(320-19-1):出荷判定試験;プロセスバリデーション;クリーニングバリデーション;QA監督

今回の対象会社は、シンガポールのOTC製造施設です。
指摘は、1)出荷判定試験; 2)プロセスバリデーション; 3)クリーニングバリデーション; 4)QA監督に関する4項目です。
WL#: 320-19-1
FDA Warning letter(CMS# 558815):水システム;微生物試験;調査;品質部門;データインテグリティ

医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、アメリカの経口液剤製造施設です。
指摘は、1)水システム; 2)微生物試験; 3)調査; 4)品質部門; 5)データインテグリティに関 ...