来年に向けて人材育成塾の講座のアップデート中

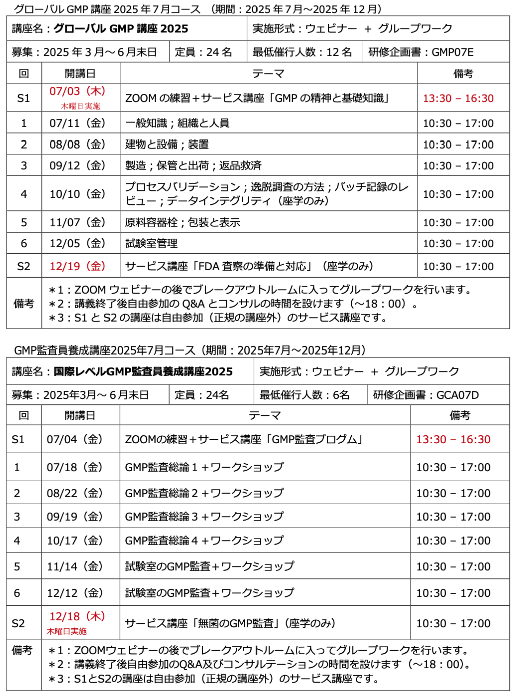
先週の金曜日に、今年度の人材育成塾の2講座(グローバルGMPとGMP監査員養成)を無事終了しました。土曜日は、修了証と受講証明書を作成して、FDA-483 の2020年度のデータ(2019年10月1日~2020年度9月30日)をアップ ...
オンラインセミナー「FDA査察の準備と対応」の募集案内

グローバルGMP講座の補講として「FDA査察の準備と対応」のセミナー開催に際し、本講座受講生以外の方の募集も行いますので、お知らせいたします。
この公開セミナーは、グローバルGMP講座の補講としてのみ実施しております。他に ...
AIの時代のDIの問題ってどうなるのかな

そこまで関わらないか…
今週は某所でデータインテグリティに関する講演をすることになっています。それで、3週間前に作成したスライドの構成を、先程再確認してみました。
GMPのトレーニングではハウツーの ...
FDA Warning letter 320-20-08

今週のWarning letterなんですが、
海外査察(CDER発信)では、先週出された2通のWarning letter(320-21-07と320-21-09)の間の番号320-21-08が掲示されました(ニコッ)。 ...
朝のメール処理

私は毎日かなり多くのメール(メーリングリスト発信)を受け取っています。数を数えたことはないのですが、夜中に着信するメールだけで30~40通はあると思います。
…今、数を数えてみました(“..)φ
FDA Warning letter(320-20-47):

世界的なコロナ禍においても、CDER管轄(米国外)Warning letterだけでも50近く発行されています。2000年前((・.・;):西暦2000前すなわち1990年代です。)の厳しさに戻ってきた感があります。
ちな ...
今日のサロンのまとめ

今日のサロンは、品質文化醸成のための役立つ周辺情報の最終回(第6回)です。
色々お話する予定ですが、まとめるとこんな感じです。
教育訓練担当者の方など、教えることにご興味をお持ちの方は、ネタ本「オトナ相手の教え ...
FDA査察が再開したら、こんなことに注意しましょう!FDAガイダンスの紹介

FDA査察が再開されたら、このガイダンスに記述されたことはレビューされる可能性が高いと個人的に感じました。そのため、皆さんに注目していただきたく、紹介します。
新しく発行された以下のガイダンスは、即施行されます。
FDA Trends 最新版

パートナーのジョン・リー氏から最新版の”FDATrends”のプロモーションビデオが届きました。ホームページに貼っておきましたので、ご覧ください。
18分のビデオなので、見ごたえありますね。この完全 ...
サロン「広場」のまとめのボード

西山経営研究所の人材育成講座(グローバルGMPとGMP監査員)の卒業生を対象に開いているサロン「広場」は、今日が15回めになります。おかげさまで、サロンは続けられそうな気がします。
前々回(品質文化と組織風土)と今回(チェ ...