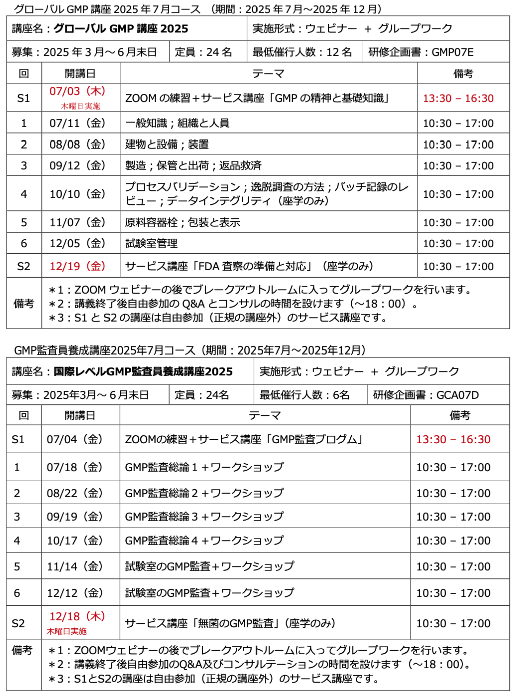
人材育成塾:グローバルGMP講座2020年1月コース受付中

2020年1月の「人材育成塾:グローバルGMP講座」の日程が決まりました。先行予約は今年11月1日の正式募集に先駆けて、優先的に予約を受け付けるシステムです。
予算や参加者が決まっていないが、まず席を確保したいという方も応 ...
Warning letter(320-19-27):API(インド):逸脱調査;装置のメンテナンス

FDAのWarning letterが掲載されました。今回の対象会社は、インドのAPI製造施設です。その他に米国のOTCメーカーとインドの製剤メーカーにWarning letterが発行されました。
OTCメーカーのWar ...
FDA Warning letter(320-19-25):中国(OTC):出荷判定試験;原料の受入試験;プロセスバリデーション;品質部門

医薬品GMPに関するFDAのCDERが発行したWarning letterを紹介します。対象会社は、中国のOTC医薬品製造施設です。
指摘は、1)出荷判定試験; 2)原料の受入試験; 3)プロセスバリデーション; 4)品質 ...
FDA Warning letter:受託試験施設(アメリカ):試験法;試験記録(GDocP);監査証跡とアクセス管理(DI);保守校正

医薬品GMPに関するFDAのWarning letterを紹介します。
あまり警告書では見られない微生物試験の問題が出ていましたので、紹介します。かなり前に、APIの微生物試験で好ましくない菌がマスキングされて合格判定され ...
FDA Warning letter(320-19-24):インドのOTC:品質部門;クリーニング;データインテグリティ

今週はFDAのWarning letterが多く掲載されました。そのうちのCDER発行のものを1通紹介します。
医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、インドのOTC製造施設 ...
FDA Warning Letter (320-19-21):インドの製剤製造施設:データインテグリティ他

今週の2通あるのですが、そのうちの1通を紹介します。
今回の対象会社は、インドの製剤製造施設です。
指摘は、1)データインテグリティ; 2)コンピュータセキュリティ; 3)に関する項目です。
WL# ...
FDAからレポートが出ました

FDAが医薬品品質に関するレポートを出しました。もちろんアメリカの事情だけですが。ご興味のある方は、以下のサイトからダウンロードできます。
国別、プロファイル別、申請別、査察の回数(初回と複数回) ...
今週のFDA Warning letter

今週は、このサイトでカバーしているWarning letterが、ざっと6通掲載されました。ざっとというのは変ですね。どうしようか迷ったものがありましたので、正確な数字ではないと言うことです。
ちなみに、このサイトではいわ ...
講座ノートがやっと完成!

今回の講座開設にともない、3月から本格的に講座ノート(テキストではなく副読本です)の見直しをしてきました。今回は平成最後の大改訂(笑)で、旧版のコースノートやチェックリストを徹底的に見直し、新たに講座ノートとして(旧版を改訂版で引き継 ...
FDAのホームページの顔が変わって、なんだか見づらいな

FDAのホームページが新しくなりました。レイアウトはシンプルで見やすいように思いますが、Warning letterやガイドや、その他多くのGMP情報を収集する側から言うと(とってもわがままなんですが)、見づらくなったなと言う感じです ...