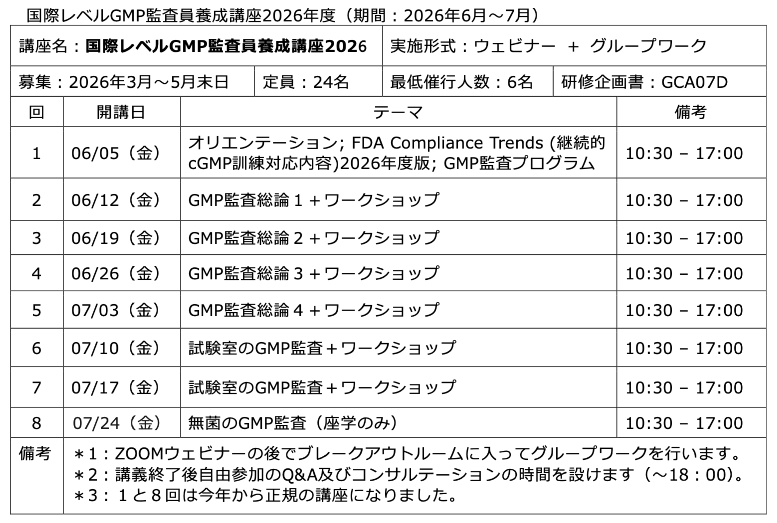
公開セミナーを開催しようと思う(2):今年の計画

いい場所が見つかりました!そこで、以下のセミナーおよび養成講座を計画しました。夏以降に実施する予定です。具体的な日程が決まりましたら、メルマガおよびホームページでお知らせします。まずは、備忘録を兼ねて書き込みました。
◆デ ...
FDA Warning letter(320-18-55):API/製剤(オーストラリア):OOS;品質部門;試験室管理;データインテグリティ

医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、オーストラリアのAPIおよび製剤製造施設です
指摘は、APIが1)OOS調査とCAPA; 2)品質部門に関する2項目、製剤が1)試験室 ...
FDA Warning Letter(320-18-53):OTC(韓国):調査;品質部門

医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、韓国のOTC医薬品製造施設です。
指摘は、1)調査; 2)品質部門に関する項目です。データインテグリティの問題が指摘されています。
GDP査察チーム

MHRA(英国の医薬品医療機器管轄当局)は、GDPの査察官を募集しているようです。
(..)φ;より専門的、本格的な査察が行われるのでしょうか?インドや中国からのルートを意識しているのでしょうか?想像でしかありませんが、G ...
FDA Warning letter(320-18-51):API(中国):逸脱とOOSの調査;データインテグリティ;GdocP

医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、中国のAPI製造施設です。
指摘は、1)逸脱とOOSの調査; 2)データインテグリティ; 3)GdocPに関する項目です。
FDA Warning letter 情報 2018-05-30

今週は警告書が3通掲載されていました。
1通は中国のAPI製造施設です。
あとの2通は、アイルランドとオーストラリアのOTC医薬品製造施設です。原料の受入試験とプロセスバリデーションは共通の指摘事例です。OTC ...
EMA Non Compliance Report (ES/NCR/GMP/1/2018):スペインの動物薬製造施設

医薬品GMPに関するEMAのNon Compliance Reportを紹介します。今回の対象会社は、スペインの動物薬製造施設です。
Non Compliance Report#: ES/NCR/GMP/1/2018
EMA Non Compliance Report (MT/001NCR/2018):インドの非無菌製剤製造施設

EMAのNon Compliance Reportが掲載されました。
医薬品GMPに関するEMAのNon Compliance Reportを紹介します。今回の対象会社は、インドの非無菌製剤製造施設です。非無菌製剤の製造、 ...
FDA warning letter(320-18-49):OTC(中国):品質管理部門(QCU)2)原料の確認試験; 3);試験記録;安定性試験

今週は、FDAのWarning letterが2通掲載されました。1通は米国、もう1通はここに紹介する中国の会社です。
今回の対象会社は、中国のOTC製造施設です。
指摘は、1)品質管理部門(QCU); 2)原 ...
GMPを勉強しよう-98-MHRA データインテグリティのガイダンス 2018年(6.20)

6.20 IT Suppliers and Service Providers (including Cloud providers and virtual service/platforms (also referred to as ...