PDA letterで「GoPro」を見るとは!

今届いたPDA letterをパラパラめくっていたら、おもしろいタイトルがあったので、紹介したい。なんと、「ビデオSOP」です。読み進んでいくと、今までのSOPと置き換えるわけではなく、例えば作業が細かく複雑で難しかったりするところを ...
FDAのWarning letter(無菌API)20170105

FDAのWarning letterが掲載されました。
今回の対象会社は、インドの無菌原薬製造施設です。無菌APIの指摘は、久しぶりですね。無菌APIは、製剤と同等のGMPが適用されますので、指摘事項には製剤GMPのセクシ ...
GMPを勉強しよう−41-QRM-事象レビューとコミュニケーション
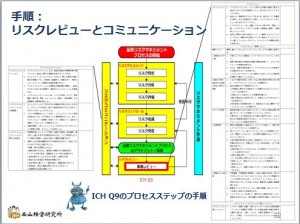
この結果のルーチンのレビュー(定期的な再評価)と突発的な事象が発生した時のレビューが、リスクレビューとして継続します。
ここでは、なにも起こらなくても定期的に再評価するレビューと、品質システム関連の突発的な事象の発生に対応 ...
GMPを勉強しよう−40-QRM-プロセスのアウトプット/結果
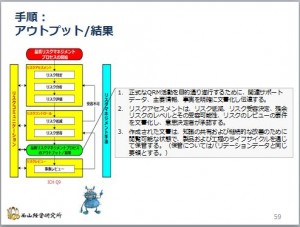
意思決定者がリスクを受容したら、この作業は一旦終了します。あとは、そのアウトプット、すなわち結果を報告書にまとめる作業が残っています。
その後は、リスクレビューで継続的なリスクマネジメント活動が行われます。
そ ...
GMPを勉強しよう-39-QRM-リスク受容
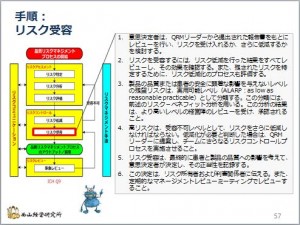
リスク低減策で、リスクのスコアがリスク受容レベルまで低減できたら、リスクを受容することになります。もし、低減策で受容レベルまで低減できない場合は、再度低減することを検討しなければなりません。
ですから、リスク低減とリスク受 ...
GMPを勉強しよう-38-QRM-プロセスの開始(番外編:QRMの手順の最初)
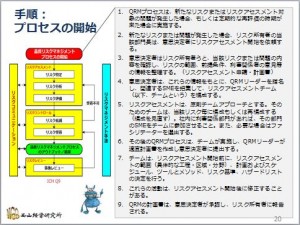
これは、番外編です。今、QRMの手順をブログに載せていますが、その前にブログに書いたものを再度掲載します。
「QRMの手順のはじめ」が、この「プロセスの開始」になります。ブログには載せているのでをすが、「GMPを勉強しよう ...
GMPを勉強しよう−37-QRM-リスク低減
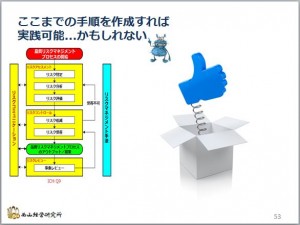
正直言いますと、「リスク評価」のステップまで、個別に各ステップの手順を書ければ、「品質リスクマネジメント」はほぼ実践できる域に達すると思います。
ここからは、「ICH Q9を読んでも分からない」ということはないと思います。 ...
GMPを勉強しよう−35-リスク評価
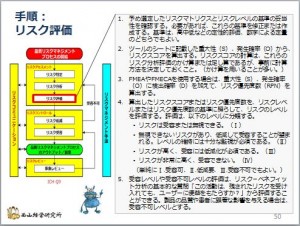
リスク分析をしたら、次のステップはリスク評価です。ここまでがリスクアセスメントの段階です。
僕がICH Q9を読んでいてふと思ったことがあります。
リスク分析で点数付けすると、リスク評価とリスク受容の判断(低減 ...
GMPを勉強しよう−33-QRM-リスク分析
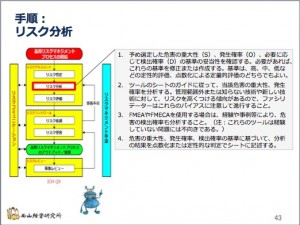
リスク特定、すなわち「ハザードのリスト化ができたら、次はリスクの分析です。左図のフローチャートのリスクアセスメントの段階のうち、赤枠のところが「リスク分析」のステップです。
ぼくの作成した手順は、例によって ...
GMPを勉強しよう-30-QRM-リスクの特定
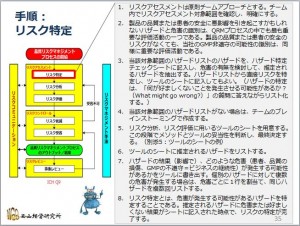
いよいよ「リスク特定」です。左図のフローチャートの「リスクアセスメント」の段階のうち、赤枠のところが「リスク特定」のステップです。
ぼくの作成した手順は、例によって左図をクリックしてください。読める大きさになります。








