FDA Warning letter(320-19-40):査察妨害

今週は医薬品のWarning letterの新たな掲載はありません。そこで、先週FDAのホームページに掲載された査察妨害に対するWarning letterにどのようなことが書かれたか見てみたいと思います。今回の対象会社は、中国の契約 ...
ペニシリンの除染の難しさについて(FDA Warning letter:320-19-33の内容から)

今日は、ペニシリンの除染の難しさについて、聞いた話をしたいと思います。FDAはたまに「~しなさい。しかしそれはかなり難しい」と言います。そのような言い方が出ていましたので、あるエピソードを紹介しようと思います。
この話は、 ...
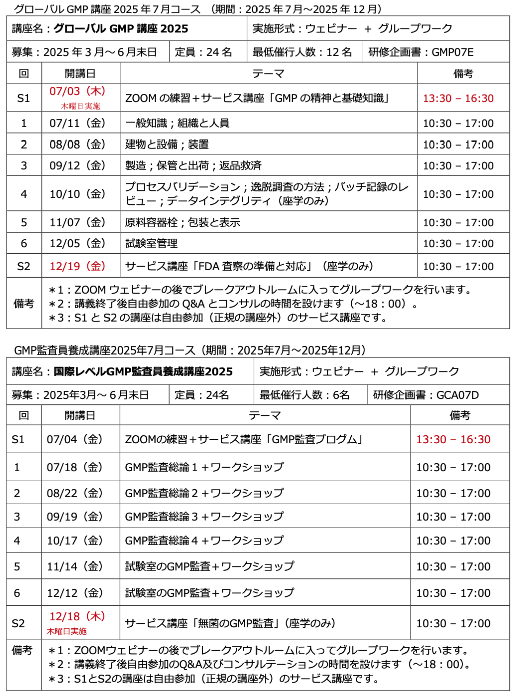
セミナー【FDA査察の準備と対応】の募集案内 募集人数12名

セミナー「FDA査察の準備と対応」の募集案内 募集人数12名
グローバルGMP講座の補講として「FDA査察の準備と対応」に関するセミナーを開催します。つきましては、本講座受講生以外の方で、このセミナーに参加ご希望される方を ...
FDA Warning letter(Case # 570944):OTC(アメリカ):品質部門;試験室管理;微生物試験手順;データインテグリティ;好ましくない微生物の試験

FDAのWarning letterが掲載されました。
医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、アメリカのOTC製造施設です。
業務全体の品質監督が求められる予感 ...
FDA Warning letter(320-19-38):OTC(韓国):出荷試験;品質部門;プロセスバリデーション;安定性

FDAのWarning letterが9月10日に掲載されました。その医薬品GMPに関するFDAのWarning letterを紹介します。今回の対象会社は、韓国のOTC医薬品製造施設です。
バッチ記録のプリントアウトでデ ...
品質メトリクスのパイロットプログラムに関するFDAのフィードバック

注:これは翻訳ではありません。説明文です。私の過去の知識もあわせて、FDAのMLの内容を解釈して状況をまとめたものです。
FDAはこれまで、品質メトリクスの自主的なフィードバックのパイロットプログラムを行ってきました。
FDA Warning letter(320-19-39):OTC(コスタリカ):出荷判定試験;原料の試験;安定性試験;装置の洗浄

今回の対象会社は、コスタリカのOTC製造施設です。これはあまり参考にはなりませんが、珍しい国だったので掲載します。OTCはクリーム剤です。
指摘は、1)出荷判定試験; 2)原料の試験; 3)安定性試験; 4)装置の洗浄に関 ...
FDA Warning letter(Case # 577583):OTC(アメリカ):調査;水システムの設計;クリーニング;安定性試験

今回の対象会社は、アメリカのOTC製造施設です。
この会社は2010年~2017年の過去4回の査察で類似のCGMP違反が見られています。
指摘は、1)調査; 2)水システムの設計; 3)クリーニング; 4)安定 ...
皆真面目なんです。言われたことはきちんとやるんですよ。しかし、逸脱が多くて…

この週末にある本を読みました。会社を更生するという平凡なテーマの小説です。
これを読んで感じたというか、同感したことがあります。それが今日のテーマ「皆真面目なんです。言われたことはきちんとやるんですよ。しかし、逸脱が多くて ...
FDA Warning letter(320-19-33):カプセル剤(トルコ):ペニシリンとの分離;ペニシリンの存在に関する試験

医薬品GMPに関するFDAのWarning letterを紹介します。
今回の対象会社は、トルコの製剤製造施設です。2週間にわたって、2箇所の査察が行われています。これらの工場CK1とCK2は、約400m離れていました。C ...