GMPを勉強しよう−42-FDAのデータインテグリティのドラフト

なんと!このタイミングで。
5月19日に「データインテグリティとグッドドキュメンテーションプラクティス」の公開セミナー(講師:ジョンリー氏)を開催するというタイミングで…
ちょっと複雑な心境です。
GMPを勉強しよう−41-QRM-事象レビューとコミュニケーション
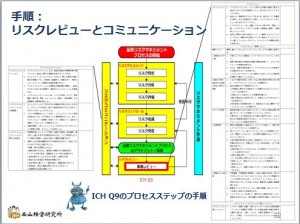
この結果のルーチンのレビュー(定期的な再評価)と突発的な事象が発生した時のレビューが、リスクレビューとして継続します。
ここでは、なにも起こらなくても定期的に再評価するレビューと、品質システム関連の突発的な事象の発生に対応 ...
GMPを勉強しよう−40-QRM-プロセスのアウトプット/結果
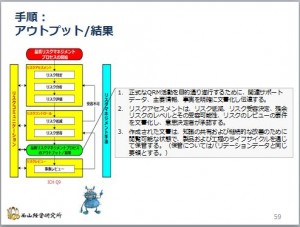
意思決定者がリスクを受容したら、この作業は一旦終了します。あとは、そのアウトプット、すなわち結果を報告書にまとめる作業が残っています。
その後は、リスクレビューで継続的なリスクマネジメント活動が行われます。
そ ...
EMA Non-Compliance Report (Insp GMP 20181/88564-0006 NCR)

このNon-Compliance Reportは、イギリス当局から発行されました(発行日2016年04月04日Report No : Insp GMP 20181/88564-0006 NCR)。対象の会社は、インドの医薬品製造業者で ...
EU-Non-Compliance Report(16MPP005NCS)-製造所の情報、文書管理、バリデーション(プロセス、クリーニング)-フランス当局

このNon-Compliance Reportは、フランス当局から発行されました(発行日2016年3月24日Report No : 16MPP005NCS)。対象の会社は、インドの医薬品製造業者です。
2016年2月12日 ...
GMPを勉強しよう-39-QRM-リスク受容
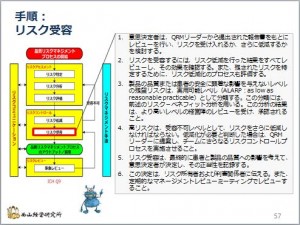
リスク低減策で、リスクのスコアがリスク受容レベルまで低減できたら、リスクを受容することになります。もし、低減策で受容レベルまで低減できない場合は、再度低減することを検討しなければなりません。
ですから、リスク低減とリスク受 ...
GMPを勉強しよう-38-QRM-プロセスの開始(番外編:QRMの手順の最初)
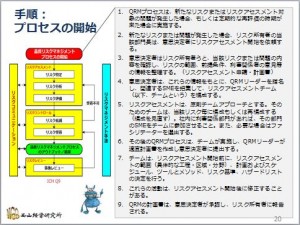
これは、番外編です。今、QRMの手順をブログに載せていますが、その前にブログに書いたものを再度掲載します。
「QRMの手順のはじめ」が、この「プロセスの開始」になります。ブログには載せているのでをすが、「GMPを勉強しよう ...
EMAーNon-Compliance Report(UK GMP 19826 Insp…:データインテグリティ、CAPA)

このNon-Compliance Reportは、英国当局から発行されました(発行日2016年3月17日Report No : UK GMP 19826 Insp GMP 19826/39398-0003 NCR)。対象の会社は、イン ...
GMPを勉強しよう−37-QRM-リスク低減
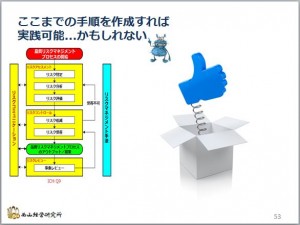
正直言いますと、「リスク評価」のステップまで、個別に各ステップの手順を書ければ、「品質リスクマネジメント」はほぼ実践できる域に達すると思います。
ここからは、「ICH Q9を読んでも分からない」ということはないと思います。 ...
GMPを勉強しよう−36-GDPサプライチェーンの完全性を保証する3ステップ

MHRA Inspectrateのブログが出た。今回はGMPではなく、GDPに関することだった。だから、GMPを勉強しようの番外編です。
サプライヤーの適格性評価について、サプライチェーンの完全性を保証するために必要な、覚 ...








