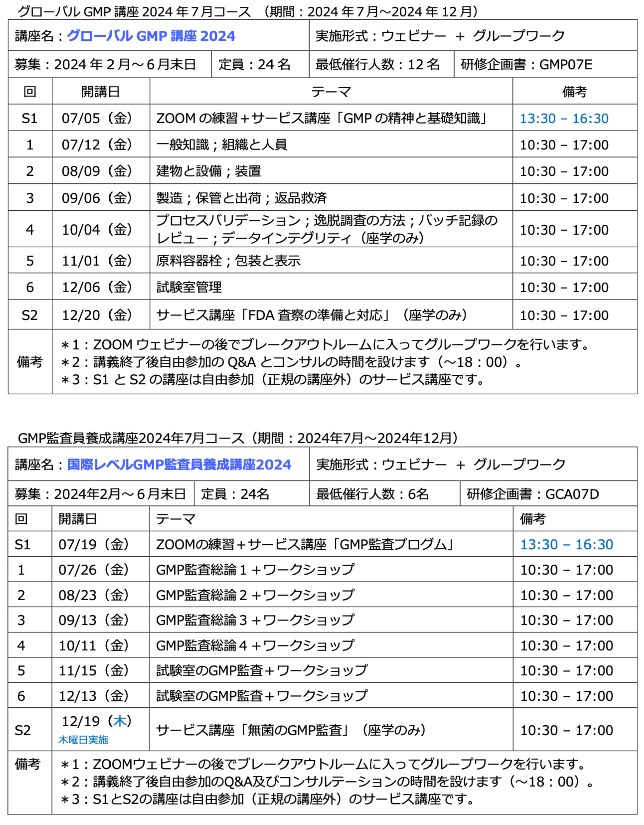
監査証跡のレビューについて(3)

PIC/Sのガイダンス9.6は、リスクマネジメントの原則に従って監査証跡のレビューの方針を決めなさいと言っています。そして、作業の重要な監査証跡はバッチ出荷判定前にレビューするべきであるとしています。
誰がレビューするかと ...
監査証跡のレビューについて(2)

前回の続きなので、この問題が決着した方には冗長な情報です。
監査証跡の確認は、誰がいつ行うのか?
マニュアルで生成した紙の記録(以下、紙の記録)と電子的方式で生成した電磁記録(以下、電磁記録)を並べて比較すると ...
監査証跡のレビューについて

監査証跡の確認は、誰がいつ行うのか?すでに答えは出ていますが、「厄介だな」とか、自分の期待と違うことは、再度「本当にそうなの。そうじゃなきゃ駄目?」みたいに考えたくなるものです。そういう点ではわりと地味なんだけど、悩みどころのある疑問 ...
フルコース終わった

先週の金曜日「FDA CGMPの解釈と応用 フルコース」の最終回を終えました。正味の内容は、820枚のスライド、講義30時間、演習3時間、Q&Aとコンサルティング6時間、休憩3時間(笑)でした。久しぶりの講義だったので、アップ ...
GMPを側面から考える

製造記録や試験記録に注記する欄を設けている会社と、空きスペースに注記する会社があります。紙の記録の場合、結論はどちらでもよいのですが、すこし別の角度から見てみたいと思います。
「注記を記録の空いているところに書く方法と、あ ...
現在無料でダウンロードできる資料

ホームページがビジーになってきたので、無料でダウンロードできる資料を整理しました。
アイキャッチのために入れていた資料の表紙が大きすぎて、ホームページのブログに到達するまで ビロ~ン と距離ができてしまったので、編集がとて ...
リモート監査のSOP、1万字を超えてしまった。

リモート監査のSOPを、粗原ですが、今日仕上げました。少し詳しめに書いたら、1万字を超えてしまいました。SOPというより、参考書ですね。
書き上げたはいいですが、時すでに遅し。日本全国自粛解除モードで動いていますので、必要 ...
リモート監査のSOPの添付資料を作ってみた。

当所のリモート監査のSOPを作ろうと思って、とりかかりました。はじめは、3時間ぐらいでできるかなとと思っていましたが、書いているうちに、あれもこれもとなって、まだ完成していません。一応フレームワークは終了しているので、あとは気の向いた ...
今日はリモート監査のSOP作ろうっと
今週も目新しいFDAのWarning letterはありませんでした。
さて今日は、午前中リモート環境づくりの機器やシステムの勉強と調査をしています。この硬い頭では、若い人のようにIT情報を素早く吸収できません。カタカナ用 ...
リモート監査の手順…少しだけ書いた。
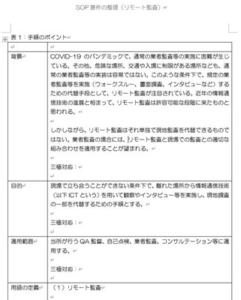
(笑)数えてみたら、グレーっぽいゴールデンウィーク(ゆっくり仕事ができるという意味では「ゴールデン」と言ってもいいかな)中に、6つのセミナー資料を作成しなければならなかった。90%完成(後は最終校閲)したのが5つで、1つ残ってしまった ...